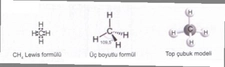
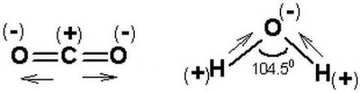Polar moleküllerin kaynama noktası neden yüksektir?
Polar moleküllerin kaynama noktalarının yüksek olmasının arkasında, moleküller arası güçlü etkileşimler yatmaktadır. Dipol-dipol etkileşimleri ve hidrojen bağları, bu moleküllerin daha fazla enerji gerektirmesine neden olur. Bu durum, kaynama noktasının yükselmesine katkı sağlar.
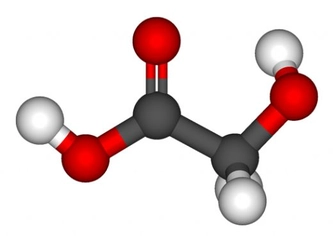
Polar Moleküllerin Kaynama Noktası Neden Yüksektir?Kaynama noktası, bir sıvının buhar basıncının, dış basınca eşit olduğu noktadır. Moleküller arasındaki etkileşimler, kaynama noktasını belirleyen en önemli faktörlerden biridir. Polar moleküller, içerdikleri pozitif ve negatif yüklerin asimetrik dağılımı sayesinde, güçlü dipol-dipol etkileşimleri ve hidrojen bağları oluştururlar. Bu makalede, polar moleküllerin kaynama noktalarının neden yüksek olduğunu inceleyeceğiz. Polar Moleküllerin Tanımı Polar moleküller, elektronegatif atomların varlığı nedeniyle elektronların asimetrik bir şekilde dağıldığı moleküllerdir. Genellikle oksijen, azot ve flor gibi elementler, bu moleküllerin polaritesini artırır. Bu özellik, moleküller arasında dipol-dipol etkileşimlerinin oluşmasına neden olur. Moleküller Arası Etkileşimler Kaynama noktasını etkileyen üç temel moleküller arası etkileşim türü bulunmaktadır:
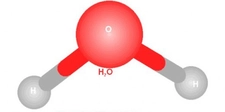
Polar moleküller, dipol-dipol etkileşimleri nedeniyle yüksek kaynama noktalarına sahiptir. Dipol-dipol etkileşimleri, pozitif ve negatif yüklerin birbirini çekmesi ile ortaya çıkar ve bu etkileşimler, moleküllerin birbirine sıkı bir şekilde bağlanmasına neden olur. Hidrojen Bağları Hidrojen bağları, özellikle polar moleküllerde yaygın olarak görülen güçlü etkileşimlerdir. Örneğin, su (H₂O) molekülleri arasında hidrojen bağları bulunur. Bu bağlar, suyun kaynama noktasının yüksek olmasının başlıca nedenlerinden biridir. Su, 100 °C'de kaynamaktadır, bu da hidrojen bağlarının etkisini gösterir. Moleküler Ağırlığın Rolü Moleküler ağırlık, kaynama noktasını etkileyen bir diğer önemli faktördür. Genel olarak, moleküler ağırlığı yüksek olan polar moleküller, daha fazla enerjiye ihtiyaç duyarlar. Bu durum, moleküller arası etkileşimlerin daha güçlü olmasına olanak tanır. Polar Moleküllerin Kaynama Noktalarını Etkileyen Diğer Faktörler Polar moleküllerin kaynama noktalarını etkileyen diğer faktörler şunlardır:
Bu faktörler, moleküller arası etkileşimlerin gücünü artırarak kaynama noktasını yükseltir. Sonuç Sonuç olarak, polar moleküllerin kaynama noktalarının yüksek olmasının temel nedenleri, moleküller arası etkileşimlerin kuvvetliliği, hidrojen bağlarının varlığı ve moleküler ağırlıktır. Bu özellikler, polar moleküllerin belirli bir sıcaklığa ulaşmadan önce daha fazla enerjiye ihtiyaç duymasına yol açar. Ekstra Bilgiler Kaynama noktası, birçok kimyasal süreçte önemli bir rol oynamaktadır. Örneğin, suyun yüksek kaynama noktası, yaşamın sürdürülebilirliği açısından kritik öneme sahiptir. Ayrıca, polar moleküllerin kaynama noktaları, endüstriyel uygulamalarda ve kimyasal sentezlerde de dikkate alınması gereken bir faktördür. Moleküler etkileşimler ve kaynama noktası arasındaki ilişki, kimya ve malzeme bilimi alanında devam eden araştırmalar için önemli bir konudur. |