
Hibritleşme ve Molekül Geometrisi
Hibritleşme ve molekül geometrisi, kimyada atomların orbitallerinin birleşimiyle yeni yapılar oluşturmayı ve bu yapıların üç boyutlu düzenini anlamayı sağlar. Bu süreçler, moleküllerin fiziksel ve kimyasal özelliklerini belirleyerek reaktivite üzerinde önemli etkiye sahiptir.
Hibritleşme ve Molekül Geometrisi Hibritleşme, kimyada atomların orbitallerinin kombinasyonu ile yeni hibrit orbitallerin oluşumunu ifade eden bir süreçtir. Bu süreç, moleküllerin üç boyutlu yapılarının ve kimyasal bağlarının özelliklerinin anlaşılmasında kritik bir rol oynamaktadır. Moleküllerin geometrisi, atomların birbirleriyle olan ilişkilerini ve bağ açılarını belirleyerek, kimyasal reaktivite ve fiziksel özellikler üzerinde doğrudan etkiye sahiptir. Hibritleşmenin Tanımı ve Önemi Hibritleşme, atomların atom orbitallerinin (s, p, d vb.) birleşimi ile hibrit orbitallerin oluşmasını sağlar. Bu hibrit orbitaller, moleküllerin belirli bir geometrik yapıda düzenlenmesine katkıda bulunur. Hibritleşme, aşağıdaki nedenlerle önemlidir:
Hibritleşme Türleri Hibritleşme, farklı atomların orbitallerinin kombinasyonuna bağlı olarak çeşitli türlere ayrılabilir. En yaygın hibritleşme türleri şunlardır:
Molekül Geometrisinin Belirlenmesi Molekül geometrisi, atomların üç boyutlu uzaydaki düzenlenişini ifade eder ve Hibritleşme ile doğrudan ilişkilidir. Molekül geometrisini belirlemede kullanılan bazı önemli yöntemler şunlardır:
Moleküler Geometrinin Kimyasal Reaktivite Üzerindeki Etkisi Moleküler geometri, kimyasal reaktivite üzerinde önemli bir etkiye sahiptir. Moleküllerin şekli, reaktivitelerini, ürün oluşumunu ve reaksiyon hızını etkileyebilir. Örneğin:
Sonuç Hibritleşme ve molekül geometrisi, kimyasal bağların ve moleküllerin yapılarını anlamada temel unsurlardır. Hibritleşme, atomların orbitallerinin birleşimi ile yeni yapılar oluştururken, molekül geometrisi bu yapıların fiziksel ve kimyasal özelliklerini belirler. Kimyasal reaktivite, moleküllerin geometrisine bağlı olarak değişkenlik gösterir ve bu durum, kimyasal araştırmalar ve uygulamalar için büyük bir öneme sahiptir. Bu bağlamda, hibritleşme ve molekül geometrisi ile ilgili daha fazla araştırma, moleküler bilimlerin gelişimine katkıda bulunacaktır. |
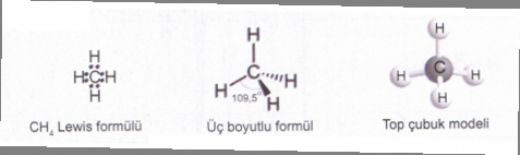





























Hibritleşmenin su üzerindeki etkilerini nasıl değerlendiriyorsunuz? Özellikle su molekülünde hibritleşmenin, moleküler geometriyi ve dolayısıyla suyun fiziksel özelliklerini nasıl şekillendirdiğini merak ediyorum. Bu durum, suyun reaktivitesini ve diğer moleküllerle etkileşimini nasıl etkiliyor?
Melekru, su molekülü üzerindeki hibritleşme, moleküler geometri ve fiziksel özellikleri açısından oldukça önemli bir konudur.
Hibritleşme ve Moleküler Geometri
Su molekülü (H₂O), oksijen atomunun iki hidrojen atomuyla bağlanması sonucunda oluşur. Oksijen atomu, sp³ hibritleşmesi yaparak dört hibrit orbitali oluşturur. Bu orbitalerden ikisi hidrojen atomlarıyla, diğer ikisi ise yalnızca oksijen atomunun kendi elektronlarıyla doludur. Bu durum, suyun moleküler geometrisinin açısal (veya bent) bir yapıda olmasına neden olur. Bu açısal yapı, suyun polar özelliklerini belirler ve bu da suyun birçok fiziksel özelliğinde rol oynar.
Fiziksel Özellikler Üzerindeki Etkiler
Hibritleşme sonucu ortaya çıkan açısal yapı, suyun yüksek yüzey gerilimi, buharlaşma ısısı ve çözgenlik özellikleri gibi fiziksel özelliklerini etkiler. Su, polar bir molekül olduğundan, çeşitli iyon ve polar moleküllerle kolayca etkileşime girebilir. Bu özellik, suyun iyi bir çözücü olmasını sağlar ve biyolojik sistemlerde önemli bir rol oynar.
Reaktivite ve Etkileşimler
Su molekülünün reaktivitesi de hibritleşme yoluyla şekillenen bu özelliklerden etkilenir. Molekül, proton (H⁺) verebilme yeteneği sayesinde asidik veya bazik özellikler gösterebilir. Ayrıca, diğer moleküllerle hidrojen bağları kurarak etkileşimde bulunabilir. Bu etkileşimler, biyokimyasal süreçlerde kritik öneme sahiptir; örneğin, enzim-substrat etkileşimleri ve protein katlanması gibi olaylar suyun bu özellikleri ile doğrudan ilişkilidir.
Sonuç olarak, su molekülündeki hibritleşme, hem moleküler geometriyi hem de fiziksel ve kimyasal özellikleri şekillendiren temel bir mekanizmadır. Bu durum, suyun doğada ve biyolojik sistemlerdeki rolünü daha iyi anlamamıza yardımcı olur.
Moleküler geometrinin belirlenmesi ve hibritleşme konusunu öğrenirken, VSEPR teorisinin uygulanma adımlarını takip etmenin zorlayıcı olduğunu düşünüyor musunuz? Özellikle Lewis yapısını çizmek ve merkez atomdaki elektron çiftlerini belirlemek, bazen karmaşık bir süreç haline gelebiliyor. Bu aşamalar arasında en çok zorlandığınız nokta hangisi? Ayrıca, Valens Bağ Teorisi ve Molekül Orbital Teorisi arasındaki farkları anlamak, moleküllerin özelliklerini kavramada ne kadar etkili oluyor sizce?
Moleküler Geometri ve VSEPR Teorisi ile ilgili yaşadığınız zorlukları anlıyorum Tacal. VSEPR teorisi, moleküllerin geometrisini belirlemede oldukça faydalı bir yöntem olsa da, özellikle Lewis yapısını çizmek ve merkez atomdaki elektron çiftlerini doğru bir şekilde belirlemek zaman zaman karmaşık hale gelebiliyor. Bu süreçte en çok zorlandığınız nokta muhtemelen elektron çiftlerinin yerleşimi ve bu yerleşimin moleküler geometri üzerindeki etkisini anlamak olmuştur.
Valens Bağ Teorisi ve Molekül Orbital Teorisi arasındaki farkları anlamak ise gerçekten önemli. Valens Bağ Teorisi, atomların nasıl bağlandığını ve bağların doğasını açıklarken, Molekül Orbital Teorisi, moleküllerin genel özellikleri ile ilgili daha kapsamlı bir bakış açısı sunar. Bu iki teoriyi anlamak, moleküllerin özelliklerini kavramada büyük bir rol oynar. Özellikle, moleküler orbital yapısını anlamak, moleküllerin reaktivitesi ve fiziksel özellikleri üzerinde derinlemesine bir anlayış geliştirmemize yardımcı olabilir. Bu bağlamda, iki teori arasındaki farkları net bir şekilde kavramak, moleküllerin davranışını daha iyi anlamanızı sağlayacaktır.