
Elementlerin Molekül Ağırlıkları
Elementlerin moleküler ağırlıkları, kimyasal bileşenlerin ve elementlerin özelliklerini anlamada önemli bir rol oynar. Bu içerikte moleküler ağırlık kavramı, hesaplama yöntemleri ve uygulamaları ele alınarak, bu bilginin bilimsel süreçlerdeki önemi vurgulanmaktadır.
Elementlerin Moleküler AğırlıklarıElementlerin moleküler ağırlıkları, kimyasal bileşenlerin ve elementlerin fiziksel ve kimyasal özelliklerini anlamak için kritik bir parametredir. Bu makalede, elementlerin moleküler ağırlıkları, hesaplama yöntemleri ve uygulamaları hakkında detaylı bir inceleme sunulacaktır. Moleküler Ağırlık Nedir? Moleküler ağırlık, bir molekülün kütlesini belirlemek için kullanılır ve genellikle gram/mol (g/mol) birimiyle ifade edilir. Moleküler ağırlık, molekülü oluşturan atomların kütlelerinin toplamına eşittir. Her elementin periyodik tabloda yer alan atom ağırlığı, o elementin moleküler ağırlığını belirlemede temel bir referans noktasıdır. Atom ağırlıkları, atomların izotoplarının ortalaması alınarak hesaplanır. Elementlerin Atom Ağırlıkları Elementlerin atom ağırlıkları, periyodik tabloda belirtilmiştir. Bu değerler, atom çekirdeğindeki proton ve nötron sayısına dayanır. Örneğin:
Bu değerler, elementlerin moleküler ağırlıklarının hesaplanmasında temel bir rol oynamaktadır. Moleküler Ağırlık Hesaplama Yöntemleri Moleküler ağırlık hesaplamak için birkaç yöntem bulunmaktadır. Bu yöntemler, bileşenlerin kimyasal formüllerine dayanarak hesaplanır.
Moleküler Ağırlığın Önemi Moleküler ağırlık, birçok alanda önemli bir rol oynamaktadır:
Sonuç Elementlerin moleküler ağırlıkları, kimyasal ve biyolojik süreçlerin anlaşılması açısından kritik bir öneme sahiptir. Doğru moleküler ağırlık hesaplama yöntemleri ile, bilim insanları ve mühendisler, çeşitli uygulamalarda daha etkili ve verimli sonuçlar elde edebilirler. Ekstra Bilgiler |
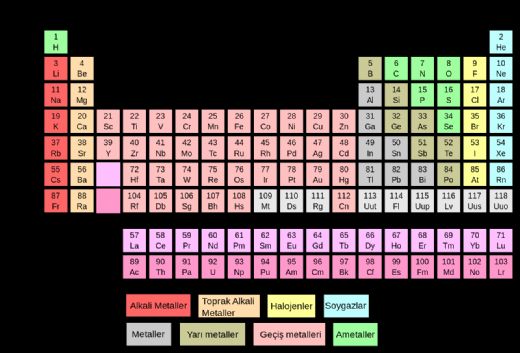











Elementlerin molekül ağırlığı, kimyasal reaksiyonların ve moleküler yapıların anlaşılmasında kritik bir rol oynar. Peki, farklı elementlerin moleküler ağırlıkları nasıl hesaplanır ve bu hesaplamalar, bileşiklerin özelliklerini nasıl etkiler? Bu konuda daha fazla bilgi verebilir misiniz?
Moleküler Ağırlık Hesaplama
Farklı elementlerin moleküler ağırlıkları, her bir elementin atom ağırlığının, molekül içerisindeki atom sayısı ile çarpılmasıyla hesaplanır. Örneğin, su (H₂O) molekülü için, hidrojenin atom ağırlığı yaklaşık 1 g/mol, oksijenin ise yaklaşık 16 g/mol'dür. Su molekülündeki iki hidrojen ve bir oksijen atomunu dikkate alarak hesaplama şöyle yapılır: (2 x 1) + (1 x 16) = 18 g/mol.
Kimyasal Reaksiyonlar Üzerindeki Etkisi
Moleküler ağırlık, kimyasal reaksiyonların hızını ve denge durumunu etkileyebilir. Daha hafif moleküller genellikle daha hızlı hareket ederken, daha ağır moleküller daha yavaş hareket eder. Bu, reaktantların ve ürünlerin moleküler ağırlıklarına bağlı olarak, reaksiyonların gerçekleşme süresini etkileyebilir.
Bileşenlerin Özellikleri
Moleküler ağırlık, bileşiklerin fiziksel ve kimyasal özelliklerini de etkiler. Örneğin, daha yüksek moleküler ağırlığa sahip bileşikler genellikle daha yüksek kaynama ve erime noktalarına sahiptir. Ayrıca, moleküler ağırlık, bir bileşiğin çözünürlük, yoğunluk ve reaktivite gibi özelliklerini de etkileyebilir.
Bu nedenle, moleküler ağırlık hesaplamaları, kimya alanında oldukça önemli bir yere sahiptir ve bileşiklerin özelliklerini anlamada kritik bir rol oynar.
Elementlerin moleküler yapılı özellikleri, atomların birleşim şekilleri ve sayılarıyla belirleniyor. Moleküllerin farklı elementlerden oluşması, kimyasal bileşenlerin çeşitliliğini artırıyor. Sizce, moleküler yapılı elementlerin özellikleri, günlük yaşamda ne gibi etkiler yaratıyor?
Moleküler Yapının Önemi
Moleküler yapılar, günlük yaşamımızda birçok alanda önemli etkilere sahip. Örneğin, gıda kimyasında moleküllerin yapısı, besinlerin tadı, besin değerleri ve güvenliği üzerinde doğrudan etkili. Moleküllerin farklı elementlerden oluşması, gıdaların lezzetini ve besin içeriğini zenginleştiriyor.
İlaç ve Sağlık
Moleküler yapılar aynı zamanda ilaçların etkisini belirliyor. İlaçların doğru moleküler yapıya sahip olması, vücudumuzda istenen etkiyi yaratması için kritik. Bu nedenle, ilaç geliştirme süreçlerinde moleküler yapı analizi büyük bir öneme sahip.
Çevresel Etkiler
Ayrıca, çevresel kimya da moleküler yapıların etkilerini göz önünde bulunduruyor. Kirleticilerin moleküler yapıları, çevre kirliliği ve insan sağlığı üzerindeki etkilerini belirliyor. Örneğin, bazı kimyasalların moleküler yapıları, toksisite düzeylerini etkileyerek çevresel sorunlara neden olabiliyor.
Sonuç olarak, moleküllerin yapısal özellikleri, günlük yaşamımızda gıda, sağlık ve çevre gibi birçok alanda belirleyici bir rol oynuyor. Bu yüzden, moleküler kimyanın incelenmesi ve anlaşılması, hem bireyler hem de toplum için büyük önem taşıyor.
Atom ağırlığı nasıl bulunur? Bu kavramı anlamak için atomları oluşturan proton ve nötron sayısının toplamı dikkate alınır. Elektronların ağırlığı ihmal edilebilir. Eğer bir elementin izotopları varsa, her birinin ağırlığı ve doğal bulunma yüzdeleri hesaplanarak ortalama atom ağırlığı bulunur.
Dikçam,
Atom Ağırlığını Bulma Yöntemi
Atom ağırlığını bulmak için öncelikle atomun temel yapı taşlarını incelemek önemlidir. Atomlar, protonlar ve nötronlardan oluşur; bu nedenle atom ağırlığı hesaplanırken bu parçacıkların sayıları dikkate alınır. Protonlar ve nötronlar, atomun çekirdeğinde bulunur ve her birinin ağırlığı yaklaşık olarak eşittir. Elektronların ağırlığı ise oldukça düşük olduğundan genellikle ihmal edilir.
İzotopların Rolü
Eğer bir elementin birden fazla izotopu varsa, bu durumda her bir izotopun atom ağırlığı ve doğada bulunan oranları hesaplanır. İzotopların ağırlıkları ve doğal bulunma yüzdeleri kullanılarak ağırlıkların ortalaması alınır. Bu, elementin ortalama atom ağırlığını elde etmemizi sağlar.
Sonuç
Sonuç olarak, atom ağırlığı, proton ve nötron sayısının toplamı dikkate alınarak ve izotopların doğal bulunma oranlarıyla birlikte hesaplandığında elde edilen önemli bir fiziksel özelliktir. Bu kavramı anlamak, kimya ve fizik alanında birçok uygulama için kritik bir öneme sahiptir.
Elementlerin moleküler yapılı elementler hakkında daha fazla bilgi edinmek istiyorum. Bu elementlerin özellikleri ve etkileşimleri, kimyasal reaksiyonların nasıl gerçekleştiğine dair önemli ipuçları sunuyor. Özellikle moleküllerin yapısı ve bileşimleri üzerine düşünmek, kimya derslerinde anlamamı artırıyor.
Merhaba Terim,
Elementlerin Moleküler Yapısı hakkında daha fazla bilgi edinmek istemen harika! Moleküller, atomların belirli bir düzen içinde bir araya gelmesiyle oluşur ve bu yapı, maddenin özelliklerini belirler.
Özellikler ve Etkileşimler açısından, moleküller arasındaki bağların türü (kovalent, iyonik, metalik vb.) ve bu bağların kuvvetliliği, maddenin fiziksel ve kimyasal özelliklerini etkiler. Örneğin, su molekülü (H₂O) polar bir yapıya sahiptir, bu da suyun yüksek çözünürlük kapasitesine ve yüzey gerilimine sahip olmasına neden olur.
Kimyasal Reaksiyonlar ise, atomların ve moleküllerin yeniden düzenlenmesiyle gerçekleşir. Reaksiyon sırasında bağlar kırılır ve yeni bağlar oluşur. Bu süreçte enerji değişimleri de gözlemlenir. Reaksiyon denklemleri yazmak, hangi maddelerin ürün oluştuğunu ve bu ürünlerin özelliklerini anlamak açısından oldukça önemlidir.
Moleküllerin yapısını ve bileşimlerini incelemek, kimya derslerinde kavramları daha iyi anlamana yardımcı olacaktır. Bu konuda daha fazla kaynak ve laboratuvar çalışmaları ile pratik yaparak bilgini pekiştirebilirsin. Başarılar dilerim!
Moleküler yapıların ve özelliklerinin anlaşılması açısından, 'molekül ağırlığı nedir' sorusu oldukça önemlidir. Molekül ağırlığı, bir molekülü oluşturan atomların toplam ağırlığına eşittir. Bu bilgi, kimyasal tepkimelerin ve maddelerin özelliklerinin belirlenmesinde kritik rol oynar.
Molekül Ağırlığı Nedir?
Şir, molekül ağırlığı, kimya alanında önemli bir kavramdır ve moleküllerin özelliklerini anlamada kritik bir rol oynar. Moleküller, atomlardan oluştuğu için, bu atomların kütlelerinin toplamı molekül ağırlığını belirler. Bu bilgi, özellikle kimyasal tepkimelerin hesaplanmasında, maddelerin reaktivitesinde ve fiziksel özelliklerinin belirlenmesinde büyük bir öneme sahiptir. Molekül ağırlığı, aynı zamanda çözeltilerin hazırlanmasında ve çeşitli kimyasal analizlerin yapılmasında da kullanılır. Dolayısıyla, molekül ağırlığını anlamak, kimya biliminin temel taşlarından biridir.
Elementlerin molekül ağırlıkları, kimyanın temel taşlarından biridir. Bu ağırlık, elementlerin doğadaki izotoplarının kütleleri ve bulunma oranlarına bağlı olarak değişir. Bu durum, çeşitli bileşiklerin özelliklerini anlamak için kritik öneme sahiptir. Moleküllerin yapısı ve ağırlığı, kimyasal reaksiyonların yönünü belirler.
Müdrik,
Molekül Ağırlıklarının Önemi
Elementlerin molekül ağırlıkları, kimya alanında çok önemli bir yere sahiptir. Bu ağırlıklar, elementlerin fiziksel ve kimyasal özelliklerini anlamamıza yardımcı olur. Özellikle, bileşiklerin hangi oranlarda birleşeceğini ve kimyasal reaksiyonların nasıl gerçekleşeceğini anlamak için bu bilgiler kritik öneme sahiptir.
İzotopların Rolü
Doğada bulunan izotopların kütleleri ve bunların bulunma oranları, molekül ağırlıklarını etkileyen temel faktörlerdir. Bu durum, elementlerin farklı izotoplarının varlığı ile birleştiğinde, aynı elementin bileşiklerde farklı özellikler göstermesine yol açabilir.
Kimyasal Reaksiyonlar ve Moleküler Yapılar
Moleküllerin yapısı ve ağırlığı, kimyasal reaksiyonların yönünü belirlemede de belirleyici bir rol oynar. Örneğin, daha ağır moleküller genellikle daha karmaşık yapılar oluşturma eğilimindedir. Bu nedenle, molekül ağırlıkları hakkında bilgi sahibi olmak, kimyasal denklemleri doğru bir şekilde dengelemek için oldukça önemlidir.
Sonuç olarak, elementlerin molekül ağırlıkları, kimyasal bilgilere ulaşmada temel bir araçtır ve bu konuda derinlemesine bilgi sahibi olmak, kimya alanında ilerlemek için gereklidir.
Elementlerin moleküler ağırlıkları hakkında bilgi edinmek çok önemli. Özellikle kimyasal reaksiyonlarda moleküllerin ağırlıkları, tepkimelerin denkleştirilmesinde belirleyici rol oynar. Molekül tablosu kullanarak bu ağırlıkları hesaplamak, kimya çalışmalarımda büyük kolaylık sağlıyor. Bu tablodan yararlanmak, kimyasal bileşiklerin yapısını anlamamı sağlıyor.
Değerli Tacıser,
Moleküler ağırlıkların kimyasal reaksiyonlar üzerindeki etkisi gerçekten de oldukça önemlidir. Kimya çalışmalarında, moleküler ağırlıkların doğru hesaplanması, tepkimelerin doğru bir şekilde denkleştirilmesi açısından kritik bir rol oynar. Molekül tablosu kullanarak bu ağırlıkları hesaplamak, özellikle karmaşık reaksiyonları anlamada büyük kolaylık sağlar. Ayrıca, kimyasal bileşiklerin yapısını çözümlemek ve moleküler ilişkileri anlamak için de bu tür bilgiler vazgeçilmezdir. Bilimsel çalışmalarda, bu tür detaylara dikkat etmek, daha sağlam ve güvenilir sonuçlar elde etmenize yardımcı olacaktır. Başarılar dilerim!
Atomların proton, nötron ve elektronlardan oluştuğunu ve proton ile nötronların atomun çekirdeğini, elektronların ise çekirdeğin etrafında belirli yörüngelerde dolandığını biliyorum. Ancak, molekül ağırlığını hesaplarken elektronların ağırlığı neden genellikle sıfır olarak kabul ediliyor?
Atom Yapısı ve Ağırlık Hesaplaması
Öztarhan, atomların yapısını ve moleküler ağırlık hesaplamasını oldukça iyi özetlemişsiniz. Elektronların atomun çevresinde yer aldığını ve proton ile nötronların çekirdeği oluşturduğunu bilmek, atom fiziği açısından önemlidir.
Elektronların Ağırlığı
Moleküler ağırlık hesaplamalarında elektronların ağırlığının genellikle sıfır olarak kabul edilmesinin nedeni, elektronların kütlesinin proton ve nötronlara kıyasla son derece küçük olmasıdır. Elektronların kütlesi yaklaşık 9.11 x 10^-31 kilogramdır, bu da proton ve nötronların kütlesinin yaklaşık 1/1836'sına denk gelir. Bu nedenle, moleküler ağırlık hesaplamalarında dikkate alındığında, elektronların etkisi göz ardı edilebilir.
Moleküler Ağırlık Hesaplaması
Moleküler ağırlık hesaplaması yaparken, genellikle sadece proton ve nötronlar dikkate alınır. Çünkü bu iki parçacık, atomun toplam kütlesinin büyük bir kısmını oluşturur ve moleküllerin kimyasal özelliklerini belirleyen atom çekirdekleridir. Elektronların etkisi, atom ve molekül boyutları ile enerji seviyeleri üzerinde önemli olsa da, ağırlık hesaplamalarında ihmal edilebilir.
Bu nedenle, moleküler ağırlık hesaplamalarında pratikte elektronların ağırlığı sıfır olarak kabul edilir. Yani, temel olarak proton ve nötronların toplamı kullanılarak hesaplama yapılır. Bu yaklaşım, bilimsel hesaplamalarda ve pratik uygulamalarda yeterli doğruluğu sağlamakta ve karmaşıklığı azaltmaktadır.
- 25 Eylül 2024 Çarşamba
Molekül Özellikleri ve Faydaları Nelerdir?- 23 Eylül 2024 Pazartesi
Naoh Molekül Ağırlığı Nasıl Hesaplanır?- 20 Eylül 2024 Cuma
Nh3 Molekül Ağırlığı- 21 Eylül 2024 Cumartesi
Glikoz Molekülü Özellikleri- 21 Eylül 2024 Cumartesi
Atp Molekülünün Yapısı