
Polar moleküllere örnekler nelerdir?
Bu içerik, polar moleküllerin tanımını ve örneklerini detaylı bir şekilde ele alıyor. Su, amonyak, klorür asit, etanol, aseton ve gliserol gibi moleküllerin polar yapıları, onların fiziksel ve kimyasal özelliklerini nasıl etkilediğini açıklıyor. Polarite, çözünürlük ve reaktivite açısından önemli sonuçlar doğuruyor.
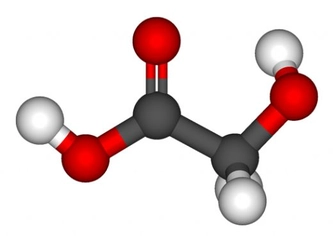
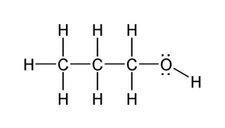
Polar Moleküllere Örnekler Nelerdir?Polar moleküller, elektrik yüklerinin simetrik olmayan dağılımına sahip olan moleküllerdir. Bu özellik, moleküllerin bir tarafının diğerine göre daha pozitif veya daha negatif bir yük taşımasına neden olur. Polarite, moleküllerin fiziksel ve kimyasal özelliklerini etkileyerek, özellikle çözünürlük ve reaktivite açısından önemli sonuçlar doğurur. Aşağıda, polar moleküllere dair çeşitli örnekler ve açıklamalar yer almaktadır. 1. Su (H₂O)Su, en bilinen polar moleküldür. Molekül, bir oksijen atomu ile iki hidrojen atomunun birleşimiyle oluşur. Oksijen atomu, hidrojen atomlarına göre daha elektronegatif olduğu için, su molekülü, hidrojen atomlarının bulunduğu bölgelerde pozitif bir yük, oksijen atomunun bulunduğu bölgede ise negatif bir yük taşır. Bu polar yapı, suyun mükemmel bir çözücü olmasını sağlar. 2. Amonyak (NH₃)Amonyak, bir azot atomu ile üç hidrojen atomunun birleşiminden oluşan polar bir moleküldür. Molekül, azot atomunun daha yüksek elektronegatifliğinden dolayı, azotun etrafındaki elektron yoğunluğu artmakta ve bu durum amonyağın polaritesini artırmaktadır. Amonyak, su ile iyi bir şekilde karışabilen ve birçok farklı bileşiğin çözünmesine yardımcı olan bir çözücüdür. 3. Klorür Asit (HCl)Klorür asit, hidrojen ve klor atomlarının birleşiminden oluşan polar bir moleküldür. Klor atomunun daha yüksek elektronegatifliği, hidrojen atomuna göre daha fazla negatif yük taşımasına neden olur. Bu özellik, klorür asidin su gibi polar çözücülerde iyi çözünmesini sağlar. 4. Etanol (C₂H₅OH)Etanol, bir hidrojen, iki karbon ve bir oksijen atomu içeren bir alkol türüdür. Oksijen atomunun varlığı, etanolün polar bir molekül olmasını sağlar. Bu nedenle etanol, su ile karışabilir ve birçok organik bileşiğin çözünmesine yardımcı olabilir. 5. Aseton (C₃H₆O)Aseton, üç karbon atomu, altı hidrojen atomu ve bir oksijen atomu içeren bir polar çözücüdür. Oksijen atomunun, molekül içindeki elektronegatifliği nedeniyle aseton, polar özellikler gösterir. Bu özellik, asetonun birçok organik bileşiği çözebilmesini sağlar. 6. Gliserol (C₃H₈O₃)Gliserol, üç karbon atomu, sekiz hidrojen atomu ve üç oksijen atomu içeren bir moleküldür. İçindeki hidroksil (-OH) grupları nedeniyle polar özellikler gösterir. Gliserol, su ile karışabilen bir çözücü olup, birçok biyolojik süreçte önemli bir rol oynamaktadır. Sonuç Polar moleküller, kimyasal ve fiziksel özellikleri açısından birçok önemli uygulamaya sahiptir. Su, amonyak, klorür asit, etanol, aseton ve gliserol gibi örnekler, bu moleküllerin çözünürlük özelliklerinin ve reaktivite potansiyellerinin belirlenmesinde büyük bir öneme sahiptir. Polar moleküllerin bu özellikleri, biyolojik sistemlerden endüstriyel uygulamalara kadar geniş bir yelpazede önemli rol oynamaktadır. Ekstra Bilgiler Polarite, moleküllerin fiziksel durumlarını ve karşılıklı etkileşimlerini etkileyen önemli bir faktördür. Bunun yanı sıra, polar moleküller, hidrojen bağları gibi güçlü etkileşimler oluşturarak, moleküller arası etkileşimleri artırır. Bu durum, suyun yüksek kaynama noktası ve donma noktası gibi özelliklerini açıklamada yardımcıdır. Polar moleküllerin varlığı, çözünme, reaktör tasarımı ve biyolojik sistemlerdeki etkileşimler açısından kritik bir öneme sahiptir. |
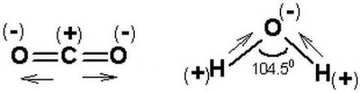




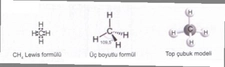
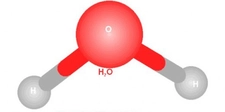
















Polar moleküllerin özellikleri ve örnekleri hakkında bilgi verirken, suyun en bilinen polar molekül olduğunu belirtmek gerçekten önemli. Su molekülünün yapısı, hidrojen ve oksijen atomları arasındaki elektronegatiflik farkından kaynaklanan polariteyi çok iyi yansıtıyor. Peki, bu polar yapı gerçekten suyun birçok çözülme ve reaktivite özelliğini etkiliyor mu? Özellikle biyolojik sistemlerdeki rolü hakkında daha fazla bilgi edinmek ilginç olurdu. Amonyak ve klorür asit gibi diğer örneklerin de polar özellikleri sayesinde su ile iyi çözünme gösterdiği belirtilmiş. Bu tür bilgiler, kimya derslerinde sıkça karşılaştığımız ancak çoğu zaman göz ardı ettiğimiz detaylar. Ayrıca, etanol ve asetona dair açıklamalar da dikkat çekici; bu moleküllerin polar özellikleri ile çözücü olarak kullanımlarını daha derinlemesine anlamak, belki günlük hayatta karşılaştığımız birçok ürünün arkasındaki bilimsel temeli kavramamıza yardımcı olabilir. Sizce polar moleküllerin bu kadar çok yönlü etkisi, endüstriyel uygulamalarda nasıl bir rol oynuyor?
Bumin,
Polar Moleküllerin Özellikleri konusunda suyun en bilinen örnek olduğunu belirtmeniz çok doğru. Su molekülü, hidrojen ve oksijen atomları arasındaki elektronegatiflik farkı sayesinde polar bir yapıya sahiptir. Bu polarite, suyun birçok çözülme ve reaktivite özelliğini doğrudan etkiler. Örneğin, su, diğer polar maddeleri iyi bir şekilde çözerken, apolar maddelerle pek etkileşimde bulunmaz. Bu özellik, biyolojik sistemlerde suyun rolünü büyük ölçüde etkiler. Hücrelerdeki birçok biyolojik reaksiyon suyun varlığında gerçekleşir ve bu da yaşamın temel taşlarından biri olarak kabul edilir.
Diğer Polar Moleküller arasında amonyak ve klorür asit de su ile iyi çözünme gösterir. Bu moleküllerin polar özellikleri, çözücü etkileşimlerini kolaylaştırarak çeşitli kimyasal reaksiyonların gerçekleşmesini sağlar. Etanol ve aseton gibi organik bileşiklerin polar yapıları, onları da su gibi polar çözücülerle iyi bir şekilde etkileşime sokar. Günlük hayatta kullandığımız birçok ürün, bu polar özellikler sayesinde etkin bir şekilde çözünür ve bu da onların etkinliğini artırır.
Endüstriyel Uygulamalar açısından, polar moleküllerin çok yönlü etkisi oldukça önemlidir. Kimya endüstrisinde solvent olarak kullanılan polar maddeler, çeşitli reaksiyonların verimliliğini artırır. Ayrıca, biyoteknoloji ve ilaç sektörlerinde polar moleküllerin kullanımı, hedeflenen etkileşimleri sağlamak için kritik bir rol oynar. Sonuç olarak, polar moleküllerin özellikleri ve etkileşimleri, endüstriyel uygulamalarda daha etkili ve verimli süreçlerin geliştirilmesine katkı sağlar. Bu nedenle, polarite ve moleküler etkileşimler üzerine yapılan araştırmalar, bilimsel ve endüstriyel gelişmeler için büyük önem taşımaktadır.